Атомарный водород - это атом водорода, состоящий из одного электрона, вращающегося вокруг ядра из одного протона. Изучение спектра атомарного водорода имеет важное значение для понимания основных принципов атомной физики и квантовой механики.
Излучение атомарного водорода осуществляется в виде серии спектральных линий, которые можно разделить на несколько типов в зависимости от их длины волны. Наиболее известной серией является Бальмеровская серия, которая включает видимые линии спектра водорода.
Важным свойством спектра атомарного водорода является его дискретность. Это означает, что атомарный водород может излучать только определенные значения энергии и, следовательно, только определенные длины волн. Это явление было объяснено Нильсом Бором в рамках своей модели атома.
Изучение спектра атомарного водорода позволяет ученым определить энергетическое строение атома и его квантовые состояния. Это знание имеет важное прикладное значение в сферах физики, химии и астрономии. Кроме того, спектр атомарного водорода является важным инструментом исследования других атомов и молекул, так как многие из них имеют аналогичную структуру и свойства.
Спектр атомарного водорода: разновидности и свойства эмиссии
Атомарный водород является одним из самых изученных и важных объектов в физике атомов. Он обладает богатым спектром, который имеет свои особенности и различные типы излучения.
Спектр атомарного водорода можно разделить на два основных типа: абсорбционный и эмиссионный.
Абсорбционный спектр
Абсорбционный спектр атомарного водорода возникает, когда атомы водорода поглощают электромагнитные волны определенной длины. При этом энергия поглощается электронами, переходящими на более высокие энергетические уровни.
Абсорбционный спектр атомарного водорода состоит из серии линий, которые соответствуют переходам между различными электронными уровнями. Каждая линия в спектре абсорбции имеет свою уникальную длину волны, которая связана с разницей в энергии между уровнями.
Эмиссионный спектр
Эмиссионный спектр атомарного водорода возникает, когда атомы водорода испускают электромагнитные волны определенной длины. Это происходит при переходе электронов с более высоких энергетических уровней на более низкие уровни.
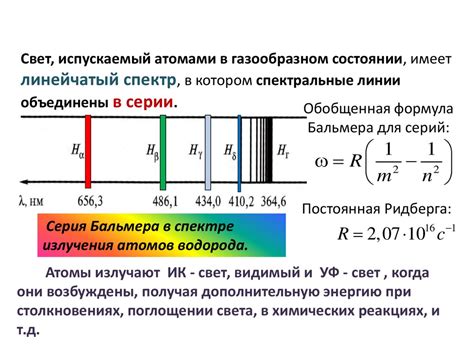
Эмиссионный спектр атомарного водорода также состоит из серии линий, но в отличие от абсорбционного спектра, он имеет ярко выраженную серию линий, называемую серией Бальмера. Линии этой серии обозначают переходы с более высоких энергетических уровней (n ≥ 3) на основной уровень (n = 2). Самая длинноволновая линия в серии Бальмера соответствует переходу с уровня n = 3 на уровень n = 2 и имеет длину волны 656,3 нм.
Эмиссионный спектр атомарного водорода также включает в себя ряд других серий линий, таких как серия Лаймана (переходы на основной уровень), серия Пашена (переходы с высоких энергетических уровней на первый возбужденный уровень) и серия Брэкетта (переходы с более высоких энергетических уровней на второй возбужденный уровень).
Спектр атомарного водорода имеет важное значение для физики и астрономии. Он помогает ученым изучать энергетическую структуру атомов, а также определять состав и характеристики звезд и других светящихся объектов в космосе.
Разнообразие линий спектра водорода
Спектр атомарного водорода является одним из наиболее изученных спектров и имеет огромное научное значение. Он помогает установить особенности взаимодействия электронов с атомом водорода и построить модели устройства атомных оболочек.
Спектр водорода состоит из серии спектральных линий, которые возникают в результате переходов электронов из одного энергетического уровня на другой. Величина энергии, освобождающаяся или поглощаемая при таких переходах, соответствует конкретным длинам волн света.
Наиболее известными линиями спектра водорода являются линии серии Бальмера - Hα, Hβ, Hγ, Hδ и так далее. Эти линии наблюдаются в видимой области спектра и отвечают за видимое излучение атомарного водорода.
Кроме того, спектр водорода включает линии серии Лаймана, которые находятся в ультрафиолетовой области спектра, и линии серии Пашена, которые расположены в инфракрасной области.
Каждая линия спектра водорода имеет свой собственный номер, который определяется энергией перехода электрона и длиной волны света. Номер линии можно выразить с помощью формулы Ритберга:
R = 1/λ, где R - константа Ритберга, а λ - длина волны света.
Спектр атомарного водорода служит основой для определения химического состава объектов в космосе. Его линии широко используются в астрономии для анализа состава звезд и газовых облаков.
Исследование спектра водорода продолжается до сих пор, и каждый новый эксперимент или наблюдение добавляет новые линии в уже известный спектр. Это позволяет углубить наше понимание атомной структуры и процессов, происходящих внутри атомов.
Формирование спектральных линий
Спектральные линии атомарного водорода образуются в результате переходов электронов между энергетическими уровнями. При переходе электрона с более высокого уровня на нижний выделяется энергия, которая испускается в виде электромагнитных волн. Каждый переход между уровнями соответствует определенной энергии и, следовательно, определенной длине волны. Длины волн спектральных линий атомарного водорода были впервые измерены Йоганном Бальмером в 1885 году.
В спектре атомарного водорода можно выделить несколько серий спектральных линий, каждая из которых соответствует определенным переходам между энергетическими уровнями электрона:
- Серия Лаймана (ультрафиолетовая серия): соответствует переходу электрона с более высоких уровней на основной (первый) уровень. В этой серии находится линия Лаймана α с длиной волны около 121,6 нм.
- Серия Бальмера (видимая серия): соответствует переходу электрона с более высоких уровней на второй (возбужденный) уровень. В этой серии находятся линии Hα, Hβ, Hγ и Hδ с длинами волн 656,3 нм, 486,1 нм, 434,0 нм и 410,2 нм соответственно.
- Серия Пашена (инфракрасная серия): соответствует переходу электрона с более высоких уровней на третий (уровень высших энергий).
- Серия Брэкетта (ултрафиолетовая серия): соответствует переходу электрона с более высоких уровней на четвертый (уровень высших энергий).
Формирование спектральных линий атомарного водорода связано с квантовыми свойствами электронов и их возможностью находиться только на определенных энергетических уровнях. Этот факт подтверждает идею о дискретном характере энергетических состояний атома и квантовых переходах между этими состояниями.
Изучение спектральных линий атомарного водорода является важным элементом физики атома и спектроскопии в целом. Они позволяют установить квантовые законы, описывающие поведение электронов в атоме, а также дают возможность исследовать состав звезд и других небесных объектов.
Влияние энергетического уровня на спектральные линии
Атомарный водород имеет уникальный спектр излучения, который связан с переходами электронов между его энергетическими уровнями. Взаимодействие света с атомами водорода может вызывать эти переходы и порождать спектральные линии.
Энергетические уровни атома водорода можно представить как ступенчатую лестницу, на каждом "ступеньке" которой находится определенное значение энергии электрона. Нижний уровень, находящийся ближе к ядру атома, имеет наименьшую энергию, а верхние уровни имеют большую энергию.
Когда электрон находится на нижнем уровне, атом водорода находится в основном состоянии. При переходе электрона с нижнего уровня на более высокий уровень атом поглощает энергию и становится возбужденным состоянием. Возбужденный атом водорода может находиться на различных энергетических уровнях, в зависимости от количества поглощенной энергии.
Когда возбужденный атом водорода возвращается к основному состоянию, он излучает энергию в виде фотонов света. Каждый энергетический уровень имеет определенные разрешенные значения энергии, что приводит к появлению спектральных линий различной длины волн.
Наиболее известными спектральными линиями атома водорода являются серия Лаймана, Бальмера, Пашена, Брахе, Пфунда и Кайцеля. Каждая из этих серий соответствует определенному переходу электрона между двумя энергетическими уровнями.
Изучение спектра атомарного водорода и его спектральных линий позволяет установить различные характеристики атомов и исследовать законы квантовой физики. Таким образом, влияние энергетического уровня на спектральные линии является важным аспектом понимания структуры атома водорода и его поведения при взаимодействии со светом.
Структура энергетических уровней водорода
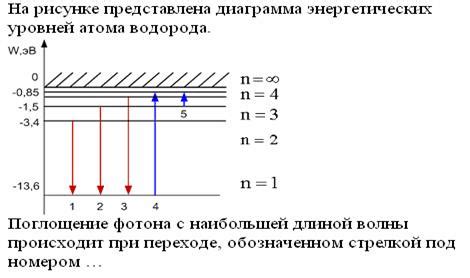
Энергетические уровни водородного атома являются основой для образования спектра излучения. Они определяют различные энергетические состояния, в которых может находиться атом водорода.
Главным образом существуют три энергетических уровня: основной, возбужденный и ионизационный.
- Основной энергетический уровень соответствует наименьшей энергии, которую может иметь атом водорода. Энергия электрона на этом уровне отрицательна и составляет -13,6 эВ. На основном уровне электрон находится ближайшим к ядру и обладает наименьшим из всех возможных радиусом орбиты.
- При переходе электрона с основного состояния на возбужденный энергетический уровень атом поглощает энергию и электрон перемещается на орбиту с более высокой энергией. Возбужденные энергетические уровни имеют значения энергии от -3,4 эВ до 0 эВ.
- Ионизационный энергетический уровень представляет собой наивысшую энергию, которую может иметь атом водорода. При переходе электрона на этот уровень, атом полностью теряет своего единственного электрона.
Энергетические уровни водорода определяются законами квантовой механики и имеют определенные энергетические значения. Переходы электронов между этими уровнями сопровождаются излучением или поглощением энергии в виде электромагнитного излучения.
Изучение энергетических уровней атома водорода позволяет более глубоко понять процессы возбуждения атомов и образования спектра излучения водорода.
Закономерности в спектре атомарного водорода
Спектр атомарного водорода, изученный Нильсом Бором в начале XX века, является одним из фундаментальных физических явлений и имеет ряд закономерностей.
- Атом водорода имеет всего одного электрона, который движется вокруг ядра.
- Энергия электрона в атоме водорода квантуется и может принимать только определенные значения.
- Каждому энергетическому уровню атома соответствует определенная энергия электрона.
- Переход электрона с более высокого энергетического уровня на более низкий сопровождается излучением электромагнитной радиации.
- Излучение атомарного водорода происходит в виде дискретных линий в спектре.
Закономерности спектра атомарного водорода объясняются с помощью квантовой механики и модели Бора, в которой электрон движется по орбитам с определенными радиусами и энергиями. Переходы электрона между орбитами сопровождаются испусканием или поглощением квантов энергии, что приводит к появлению спектральных линий.
Явление аномального доплеровского смещения
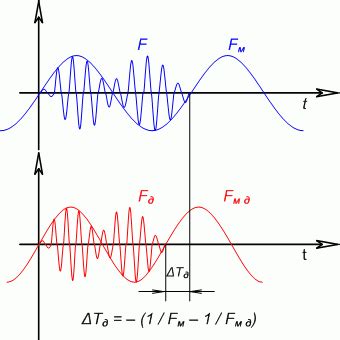
Явление аномального доплеровского смещения - это феномен, наблюдаемый при изучении спектра атомарного водорода, который не объясняется классической теорией Доплера. Согласно классической теории Доплера, частота излучения волнового процесса должна изменяться в зависимости от движения источника. Однако, при определенных условиях, при излучении атомарного водорода, наблюдаются спектральные линии, которые значительно отклоняются от предсказанных значений Доплера.
Аномальное доплеровское смещение в спектре атомарного водорода может быть вызвано рядом факторов:
- Эффект Рамзауэра - взаимодействие электрона с ядром атома водорода может приводить к изменению его энергетического состояния, что влияет на спектральные линии;
- Эффект Старка - внешнее электрическое поле может вызывать смещение спектральных линий из-за взаимодействия электрона с полем;
- Квантовые эффекты - квантовые эффекты, такие как учет волновой природы частиц, могут вызывать аномальное смещение линий в спектре атомарного водорода.
Аномальное доплеровское смещение в спектре атомарного водорода было открыто и описано учеными в начале XX века и продолжает являться предметом интереса исследований в физике.
Взаимодействие магнитного поля и спектра водорода
Магнитное поле может оказывать влияние на спектр атомарного водорода, проявляясь в виде эффекта Зеемана. Этот эффект был открыт в 1896 году голландским физиком Питером Зееманом и позволил установить взаимосвязь между спектральными линиями атома водорода и внешним магнитным полем.
Под действием магнитного поля спектр водорода расщепляется на несколько компонент. Каждая линия спектра водорода расщепляется на три линии: центральную и две боковые. Центральная линия соответствует переходу электрона между двумя стационарными состояниями атома, а боковые линии связаны с поглощением или испусканием кванта света мысленным электроном, движущимся в магнитном поле.
Количество расщепленных линий при взаимодействии с магнитным полем зависит от суммы орбитального момента и спина электрона. Для электрона в атоме водорода существуют две возможности: орбитальный момент равен 0 и спин равен 1/2 или орбитальный момент равен 1 и спин равен 1/2. В первом случае происходит расщепление спектра на две линии, во втором случае - на три линии.
С помощью эффекта Зеемана можно изучать структуру атомов водорода и других элементов, а также исследовать взаимодействие атомов с магнитными полями. Этот эффект находит применение в астрономии и ядерной физике, а также в оптике и спектроскопии.
Роль спектра водорода в физическом и химическом анализе

Спектр водорода играет важную роль в физическом и химическом анализе, предоставляя исследователям ценную информацию о свойствах атома водорода и его взаимодействии с другими веществами. Этот спектр является формой визуального представления, которая содержит информацию о различных энергетических состояниях, переходах и излучениях атомов водорода.
Изучение спектра водорода позволяет установить энергетические уровни и переходы, которые происходят в атоме водорода. Это в свою очередь позволяет исследователям определить свойства и характеристики атома водорода, такие как энергия, радиус, масса и спин электрона.
Спектр водорода также имеет применение в астрофизике. Изучение спектра водорода, полученного от звезд и галактик, позволяет исследователям получить ценную информацию о составе и физических свойствах этих объектов.
Кроме того, спектр водорода играет важную роль в химическом анализе. Исследование спектра водорода позволяет установить химический состав и структуру различных веществ. Например, спектр водорода может использоваться для идентификации химических элементов и соединений, определения их концентрации и исследования химических реакций.
Выводы, полученные из анализа спектра водорода, являются основой для различных научных исследований и применений. Это позволяет углубить наши знания о мире атомов и молекул, а также расширить возможности в областях физики, химии и астрофизики.
Вопрос-ответ
Что такое спектр атомарного водорода?
Спектр атомарного водорода - это набор характеристических линий или полос, которые возникают при излучении энергетических уровней водорода. Они образуются в результате перехода электрона между различными энергетическими уровнями атома водорода.
Какие типы спектров атомарного водорода существуют?
Спектры атомарного водорода можно разделить на три типа: лаймановский, бальмеровский и пашеновский спектры. Лаймановский спектр отвечает за переходы электронов на основной энергетический уровень, бальмеровский спектр - на первый возбужденный уровень, а пашеновский спектр - на второй возбужденный уровень.
Какие особенности имеет спектр атомарного водорода?
Самая важная особенность спектра атомарного водорода - это то, что его спектральные линии образуют серию, которая соответствует дискретным энергетическим уровням атома водорода. Каждая серия представляет собой набор линий, частоты которых соответствуют определенным энергетическим уровням.
Какие применения имеет спектр атомарного водорода?
Спектр атомарного водорода имеет широкое применение в научных и технических областях. Он используется для определения состава и структуры веществ, в физике атомов и молекул, а также в астрономии для изучения свойств удаленных объектов. Кроме того, спектр атомарного водорода играет важную роль в разработке новых методов и приборов для измерения различных параметров.







